プレスリリース
オキシステロールによる細胞死誘導の複雑なメカニズムの解明に成功
ポイント
- 筋萎縮性側索硬化症患者などで増加する25-ヒドロキシコレステロール(以下、25-OHC)が、培養シュワン細胞に鉄依存性細胞死であるフェロトーシスを誘導した。
- 25-OHCによるフェロトーシスは脂質過酸化物産生能の上昇と除去能の低下が協調的に起きて誘導された。
- 25-OHCが増加することで細胞死が起こる疾患に対してフェロトーシスの阻害剤が有効である可能性が期待される。
概要
同志社大学大学院生命医科学研究科 浦野教授、野口教授らの研究グループは、コレステロールが酵素的に酸化されて生じるオキシステロールの一つである25-ヒドロキシコレステロール(25-OHC)が、「フェロトーシス」という特定の細胞死を誘導することを明らかにしました。この細胞死は、筋萎縮性側索硬化症(ALS)など、いくつかの変性疾患に関与している可能性があります。
コレステロール酸化物である25-OHCは様々な生理的役割をもつ一方で、ALS患者の脳脊髄液中や脊髄において顕著に増加することが報告されています。ALS発症において運動ニューロンの変性に加え、ミエリン形成細胞の変性と脱髄が見られることから、本研究ではミエリン形成細胞としてマウスシュワン細胞株であるIMS32を用いて25-OHCがシュワン細胞に及ぼす影響を解析しました。その結果、25-OHCは濃度依存的に細胞死を誘導し、その細胞死形態として脂質過酸化を伴う鉄依存性の細胞死であるフェロトーシスであることを見出しました。さらに細胞死誘導機構として25-OHC処理した細胞では脂質過酸化物の産生能が上昇することと、脂質過酸化物の除去能が低下することが協調的に起きてフェロトーシスが誘導されることを発見しました。また食品性抗酸化物であるビタミンEが25-OHC誘導性細胞死の有効な阻害剤となることを明らかにしました。本研究により25-OHCの増加が起因して起こる細胞死が関与する疾患に対してフェロトーシスの阻害剤やビタミンEが有効となる可能性が期待されるほか、オキシステロールが正常および病理学的プロセスにどのように関与しているのかを理解する上で大きな進展を示しています。これらの新しい知見により、困難な疾患に対する革新的な治療法や診断法の開発が期待されます。
背景
細胞死はアポトーシスに代表される制御された細胞死(Regulated cell death、RCD)と壊死に大きく分けられますが、近年の研究でRCDに分類される非アポトーシス性の新たな細胞死形態が次々と明らかにされています。その例として、アポトーシスが抑制されたときにおこる代替的な細胞死であるネクロプトーシス、自然免疫系の細胞に見られる炎症誘導性細胞死であるパイロトーシス、脂質に対する酸化的損傷によって誘導される鉄依存的な細胞死であるフェロトーシス等が挙げられます。特にフェロトーシスは、非アルコール性脂肪性肝炎(NASH)の肝細胞死で認められる形態であることや、鉄を豊富にもつがん細胞の特異的な細胞死誘導機構としても注目されています。
本研究で対象とした25-OHCは、主に肝臓やマクロファージ等でcholesterol 25-hydroxylase(CH25H)によってコレステロールが酸化されて産生されるオキシステロールです。25-OHCはコレステロール異化過程の産物であるのに加え、核内受容体である転写因子Liver X Receptor (LXR) のリガンドとして細胞からのコレステロールの排出を調節する役割をもつことや、コレステロール恒常性を担う制御因子Sterol regulatory element-binding proteins (SREBPs) の抑制性因子としてもはたらきます。一方で生活習慣病やがん、神経変性疾患をはじめ、最近ではSARS-CoV-2の感染を抑制する効果が報告されるなど様々な疾患で、25-OHC量の変動が病因に関与することを示す報告もあり、活発に研究が行われています。
研究成果
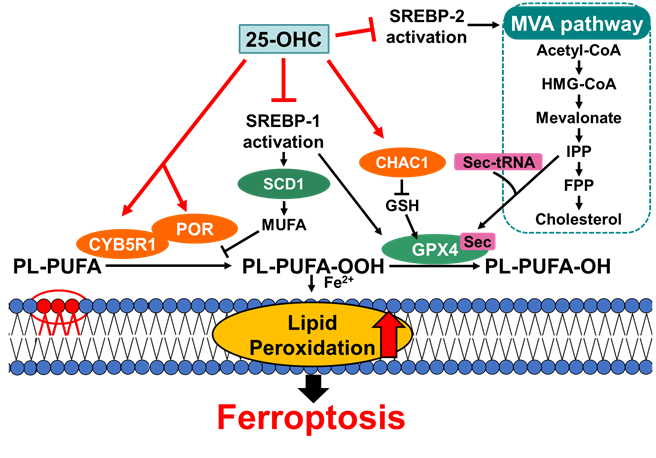
本研究ではミエリン形成細胞としてマウスシュワン細胞株であるIMS32を用いて細胞生存率に与える評価した結果、25-OHC誘導性細胞死は鉄キレート剤やビタミンE等の抗酸化剤で抑制されることや、脂質ラジカルの増加が起きること等からフェロトーシスが起きていることを明らかにしました。さらに25-OHCによってSREBPの活性化が阻害されることで、脂質過酸化物の除去を行うセレノプロテインであるGlutathione peroxidase 4 (GPX4)の転写や翻訳が抑制されることを見出しました。さらに25-OHCは脂質過酸化を促進する酵素であるNADH-cytochrome b5 reductase 1 (CYB5R1) とNADPH-cytochrome P450 reductase (POR)の発現を増加させ、CYB5R1の発現を抑制した場合にはフェロトーシスが抑制されることを明らかにしました。また抗酸化物質であるグルタチオンを分解するgamma-glutamylcyclotransferase 1(CHAC1)の発現量も増加し、細胞内グルタチオン量が減少することも明らかにしました。あわせて細胞毒性のない25-OHCにおいてもGPX4の発現が低下し、既存のフェロトーシス誘導剤に対する細胞感受性を高めることも見出しています。以上の結果から、25-OHCはSREBP経路の抑制と細胞内の酸化還元バランスの不均衡を誘導するという多面的な効果によりフェロトーシスを引き起こすという新規の機構を明らかにしました(図1)。本研究成果はALSをはじめ25-OHCの過剰な増加が原因となって起こる細胞死を伴う疾患に対してフェロトーシスの阻害剤やビタミンEが有効な治療薬となる可能性が期待されます。
本研究成果は「Downregulation of the SREBP pathways and disruption of redox status by 25-hydroxycholesterol predispose cells to ferroptosis」の題目にて国際学術誌のFree Radical Biology and Medicine誌に2025年1月 6日付で公表されています(オープンアクセス)。
論文情報
- 掲載誌:Free Radical Biology and Medicine
- 論文タイトル:Downregulation of the SREBP pathways and disruption of redox status by 25-hydroxycholesterol predispose cells to ferroptosis
- 著者:Yasuomi Urano, Anan Iwagaki, Arisa Takeishi, Nazuna Uchiyama, Noriko Noguchi
- DOI:10.1016/j.freeradbiomed.2025.01.010
研究者プロフィール
浦野 泰臣(ウラノ ヤスオミ)Yasuomi URANO
同志社大学大学院 生命医科学研究科 教授
研究分野:神経変性疾患 / 細胞死 / 脂質代謝
野口 範子(ノグチ ノリコ)Noriko NOGUCHI
同志社大学大学院 生命医科学研究科 教授
研究分野:酸化ストレス/ ビタミン / 生活習慣病
| 本研究に関するお問い合わせ |
同志社大学 生命医科学研究科 浦野 泰臣 教授 TEL:0774-65-6260 |
|---|
| 取材に関するお問い合わせ |
同志社大学 広報部広報課
TEL:075-251-3120 |
|---|
- タグ
- 教育・研究